Test-Rápidos SARS-CoV-2: Uso Racional
- Noticiero Medico

- 3 jul 2020
- 4 Min. de lectura
Actualizado: 1 feb 2021
Klever Sáenz-Flor M. PATH
Director Postgrado de Patología Clínica, Universidad Central del Ecuador. Presidente Sociedad Ecuatoriana de Patología Clínica. Vicepresidente – Acreditación Asociación latinoamericana de Sociedades de Patología Clínica. Quality Manager – Synlab Solutions in Diagnostics Ecuador.
Durante los últimos meses, se ha evidenciado una proliferación importante en el mercado de test de diagnóstico rápido para SARS-CoV-2. Hasta el 17 de junio en el Ecuador, se encuentran autorizados más de 300 test de este tipo, donde predominan los test serológicos para detección de anticuerpos, algunos totales y en su mayoría IgG e IgM.¹
La Sociedad Española de Bioquímica Clínica y Patología Molecular define a un Ensayo o prueba rápida como un análisis de muestras biológicas realizado fuera de las instalaciones de una laboratorio, para diagnosticar una enfermedad o establecer una condición (p.e. respuesta inmune); en proximidad con el paciente y puede tratarse ya sea de procedimientos manuales, automáticos o semiautomáticos, donde el operador debe ser capacitado para evitar errores en el procedimiento e interpretación del test.²
Los ensayos rápidos, en términos generales, tienen varios riesgos, por lo que es recomendable emplear métodos verificados en las condiciones de uso, para evidenciar su desempeño, a lo que debe sumarse la evaluación por lotes, dada la posibilidad de variaciones entre ellos. Si bien los test rápidos requieren un bajo nivel de entrenamiento, éste es muy importante para asegurar las condiciones de uso en base a las recomendaciones del fabricante, ya que cualquier desviación puede generar errores en el reporte que lleven a la pérdida de casos (falsos negativos) o a la categorización errónea de personas sanas como enfermos (falso positivos).³’ ⁴ Para la validación de los ensayos rápidos se recomienda utilizar guías como la del CLSI EP12-A2 ⁵
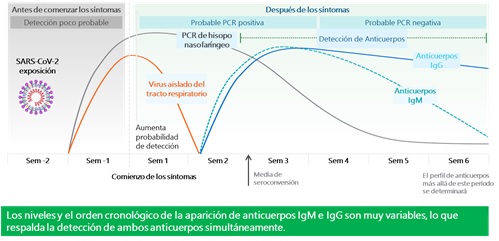
Actualmente, las respuestas de anticuerpos contra el SARS-CoV-2 siguen siendo poco conocidas y la utilidad de las pruebas serológicas no es clara.⁶ sin embargo su uso debe estar vinculado a la historia natural de la enfermedad y a la respuesta inmune evidenciada a lo largo de la misma. (Figura 1) .
Figura 1. Curso Estimado de Biomarcadores moleculares y serológicos para SARS-CoV-2.
Adaptado de: Sethuraman et al. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. Published online May 06, 2020. doi:10.1001/jama.2020.8259
A pesar de un rápido aumento en el número y la disponibilidad de ensayos serológicos para detectar anticuerpos contra el SARS-CoV-2, la mayoría ha tenido una validación externa mínima o nula, muchas veces con paneles de validación mal descritos, lo que dificulta la selección del ensayo y la interpretación de los resultados. La interpretación de los ensayos serológicos es limitada en la actualidad debido a lagunas de conocimiento crítico. Por ejemplo, no se han identificado correlatos serológicos definitivos de protección contra infecciones o enfermedades en humanos, y el grado en que estos ensayos reaccionan de forma cruzada con anticuerpos contra coronavirus relacionados no es concluyente.⁷
Lo cierto, es que ante la presión sanitaria, al igual que lo sucedido para la caracterización de SARS-CoV, la sensibilidad de los ensayos (el número de muestras positivas que se pudieron determinar correctamente) y la especificidad de los mismos (medida por el número de muestras negativas que se pudieron identificar correctamente) podrían ser difíciles de determinar, especialmente por la seroprevalencia poblacional de anticuerpos contra el CoV del resfriado común combinada con la presencia de anticuerpos de reacción cruzada contra partes conservadas de las proteínas CoV inmunogénicas ⁸
La sensibilidad de las pruebas de anticuerpos es demasiado baja en la primera semana desde el inicio de los síntomas (día 10 a 14 de infección), para tener un rol principal en el diagnóstico de COVID-19, aunque puede complementar otras pruebas, especialmente en fases tardías de la infección, cuando las pruebas de RT-PCR son negativas. ⁹
Si bien muchos países han ampliado la disponibilidad de las pruebas moleculares para el diagnóstico de enfermedad activa, algunos han incorporado estudios de vigilancia serológica de respuesta pandémica a SARS-CoV-2; esto estudios permitirán establecer la dinámica de transmisión de la enfermedad y mejorar las estimaciones de carga de la enfermedad mediante la identificación de personas que superaron la enfermedad incluso siendo asintomáticos y proporcionar información sobre la cinética de la inmunidad humoral. Algunos autores sugieren además su uso como complemento de los métodos moleculares para Diagnóstico en ciertos escenarios clínicos(7). (Tabla 1).
Aunque en algunas circunstancias es necesario el uso de pruebas serológicas rápidas, la evidencia actual ha demostrado que para la infección temprana por SARS CoV-2 presentan baja sensibilidad y, por lo tanto, no es recomendable como única prueba para determinar posibles infecciones activas, en el caso de la Covid2, la única prueba que confirma un caso de enfermedad activa con riesgo de contagio es el RT-PCR ¹⁰
Tabla 1. Casos de usos posibles para test de detección de anticuerpos
Tomado y adaptado de: Cheng MP, Yansouni CP, Basta NE, Desjardins M, Kanjilal S, Paquette K, et al. Serodiagnostics for Severe Acute Respiratory Syndrome–Related Coronavirus-2. Ann Intern Med. 2020;1–12
Referencias
1. (ARCSA), Angencia de Regulación C y VS. PRUEBAS RÁPIDAS (Aprobados durante la emergencia sanitaria) [Internet]. 2020 [cited 2020 Jun 30]. p. 26. Available from: https://www.controlsanitario.gob.ec/wp-content/uploads/downloads/2020/06/Pruebas-Rápidas-aprobadas-durante-la-emergencia-17-junio-2020.pdf
2. Rioja RG, Kirchner MJA, Funes VÁ, Meseguer NB, Rius MC, Llopis MA, et al. Revista del Laboratorio Clínico. 2009;2(4):185–95.
3. Benítez-Estévez AJ, Otero Santiago MF, Oliver Sáez P, Lirón Hernández J, Rodríguez Cantalejo F, Sánchez Mora C, et al. Recommendations for constructing a balanced scorecard for point-of-care testing (POCT) management. Recommendation (2017). Rev del Lab Clin [Internet]. 2018;(xx):1–10. Available from: https://doi.org/10.1016/j.labcli.2018.09.001
4. WHO. Advice on the use of point-of-care immunodiagnostic tests for COVID-19. 2020;(April):1–6.
5. CLSI/NCCLS. CLSI EP12-A2. User Protocol for Evaluation of Qualitative Test Performance; Approved Guideline. Vol. 28, Clinical and Laboratory Standards Institute. 2008. 64 p.
6. Long QX, Liu BZ, Deng HJ, Wu GC, Deng K, Chen YK, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020;
7. Cheng MP, Yansouni CP, Basta NE, Desjardins M, Kanjilal S, Paquette K, et al. Serodiagnostics for Severe Acute Respiratory Syndrome–Related Coronavirus-2. Ann Intern Med. 2020;1–12.
8. Meyer B, Drosten C, Müller MA. Serological assays for emerging coronaviruses: Challenges and pitfalls. Virus Res [Internet]. 2014;194:175–83. Available from: http://dx.doi.org/10.1016/j.virusres.2014.03.018
9. Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S, et al. Antibody tests for identification of current and past infection with SARS-CoV-2. Cochrane database Syst Rev [Internet]. 2020;6:CD013652. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32584464
10. Döhla M, Boesecke C, Schulte B, Diegmann C, Sib E, Richter E, et al. Rapid point-of-care testing for SARS-CoV-2 in a community screening setting shows low sensitivity. Public Health. 2020;182(April):170–2.








Comentarios