Test diagnósticos SARS-CoV2: Interpretación y recomendaciones de uso
- Noticiero Medico

- 4 oct 2020
- 8 Min. de lectura
Actualizado: 1 oct 2021
Klever Sáenz-Flor M.PATH
Director Postgrado de Patología Clínica. Universidad Central del Ecuador. Presidente Sociedad Ecuatoriana de Patología Clínica, Vicepresidente – Acreditación Asociación latinoamericana de Sociedades de Patología Clínica, Director Médico / Gerente de Calidad. Synlab Solutions in Diagnostics Ecuador.
Al momento la enfermedad por coronavirus 2019 (COVID-19), causada por SARS-CoV-2, continúa siendo pandémica. En el país, al analizar el exceso de muertes a partir de la información publicada por el registro civil (32724 muertes entre marzo & agosto 2020) comparado a igual periodo promedio 2018-2019, se espera, considerando una letalidad del 2.5%, un total de 1´308 960 sujetos que han cursado la enfermedad. Estos datos permiten establecer una prevalencia poblacional de enfermedad aproximada hasta esa fecha del 7.4% (1´308 960/17´510 643).¹
En el contexto de la pandemia se han desarrollado varios tipos de pruebas diagnósticas desde ensayos de Biología Molecular (RT-qPCR), pasando por test de diagnóstico junto a paciente (POCT) para detección de antígeno, test POCT serológicos para anticuerpos totales e IgG e IgM para SARS-CoV2, así como tets inmunométricos sean éstos ELISA, Fluorescentes (FIA) Quimioluminiscentes (QL) o Electroquimioluminiscentes (EQL).²
La amplia gama de test disponibles y autorizados en el mercado diagnóstico del país, donde predominan los test “rapidos” (POCT) (Ver Tabla 1) torna imperiosa la necesidad de entender su uso en el contexto de la historia natural de la enfermedad.³
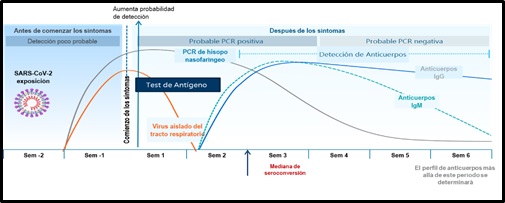
El conocimiento de estas pruebas diagnósticas vinculado a su naturaleza y la interpretación de sus hallazgos en el contexto clínico y de evolución de la enfermedad, es importante desde todo punto de vista por cuanto su interpretación y utilidad clínica variará a lo largo de la historia natural de la enfermedad. (Figura 1).²
Figura 1. Pruebas diagnósticas variación estimada en el tiempo para la detección de SARS-CoV2, en relación con el tiempo de contacto y aparición de síntomas. Tomado y adaptado de: Sethuraman et al. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA.Publicado online Mayo 06, 2020. doi:10.1001/jama.2020.8259
En este contexto, es muy importante considerar entonces las pruebas diagnósticas en su uso clínico y en las peculiaridades de su desempeño bajo la premisa de que ninguna prueba diagnósticas tiene una confiabilidad al 100% y que por ende siempre existe la posibilidad de resultados falso positivos o falsos negativos, dependiendo del test seleccionado y su uso clínico.⁴
RT-PCR para SARS-CoV2
Las tasas de falsos negativos para pruebas covid-19 (RT-PCR) pueden oscilar entre el 2% y el 29% (equivalente a sensibilidades del 71 al 98%). Estos falsos negativos pueden estar
asociados no solamente al desempeño del test, sino a la calidad de la muestra de hisopado tomada, del sitio de toma, siendo el combinado oro y nasofaríngea la muestra no invasiva de mejor desempeño. La capacidad diagnóstica de este test también se ve afectada, conforme se muestra en la figura 1 por el estadio de la enfermedad y el grado de replicación viral, a lo que se suma el impacto que tiene también los genes diana que se usen en este tipo de ensayos.⁵
Considerando lo dicho, queda claro que una prueba de RT-PCR positiva para la prueba de covid-19 tiene más peso que una prueba negativa debido a la alta especificidad, pero la sensibilidad variable de la prueba, la expone a una mayor probabilidad de resultados falsos negativos.⁴
Las pruebas negativas deben interpretarse con precaución, teniendo en cuenta la probabilidad de enfermedad previa a la prueba (probabilidad pre-test). Los resultados falsos negativos conllevan riesgos sustanciales; los pacientes pueden ser trasladados a salas sin covid-19, lo que provocaría la propagación de la infección adquirida en el hospital, los cuidadores pueden transmitir la infección a dependientes vulnerables y los trabajadores de la salud corren el riesgo de transmitir a personas vulnerables.⁴
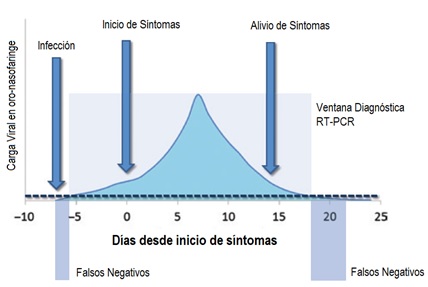
Los hallazgos de estos resultados falsos negativos son concordantes con el desempeño diagnóstico y la historia natural de la enfermedad, donde para ensayos RT-PCR se evidencian al menos dos zonas grises atribuible a las bajas cargas virales, especialmente en pacientes asintomáticos o levemente sintomáticos (Figura 2). La primera zona gris se corresponde a la fase inicial de la infección, cuando el paciente todavía está completamente asintomático o sólo levemente sintomático. Es posible que la diseminación de virus ya haya iniciado pero que su carga no sea lo suficientemente alta para ser detectada por el RT-PCR; por otra parte en el convalecencia temprana (final de síntomas para pacientes sintomáticos) se encuentra la segunda zona gris, donde la carga viral también podría encontrarse por debajo de la sensibilidad analítica del método.⁶’ ⁷
Actualmente el uso de la RT-PCR está establecido exclusivamente para el diagnóstico de la enfermedad y no está recomendado para el alta / des confinamiento, considerando lo siguiente, de acuerdo a la guía provisional actualizada de mayo del 2020 publicada por la Organización Mundial de la Salud:⁸
Largos períodos de aislamiento para individuos con detección prolongada de ARN viral después de la resolución de los síntomas, lo que afecta el bienestar individual, la sociedad y el acceso a la atención médica
Capacidad de prueba insuficiente para cumplir con los criterios de alta inicialmente recomendado en muchas partes del mundo. (La recomendación inicial para confirmar la eliminación del virus y, por lo tanto, permitir el alta del aislamiento, requería que un paciente se recuperara clínicamente y que tuviera dos resultados de RT-PCR negativos en muestras secuenciales tomadas con al menos 24 horas de diferencia)
Exposición viral prolongada alrededor del límite de detección, con resultados negativos seguidos de resultados positivos, lo que desafía innecesariamente la confianza en el sistema de laboratorio.
Figura 2. Correspondencia entre el desarrollo de la carga viral durante la infección por coronavirus 2 (SARSCoV-2) del síndrome respiratorio agudo severo, el curso clínico y la positividad de los ensayos (en tiempo real) de reacción en cadena de la polimerasa con transcripción inversa (RT-PCR). Tomado y adaptado de: Lippi, et al Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019 (COVID-19).March 2020. https://doi.org/10.1515/cclm-2020-0285
Los Criterios vigentes para dar de alta a los pacientes del aislamiento (es decir, descontinuar las precauciones basadas en la transmisión) sin requerir una nueva prueba, son:⁸
Para pacientes sintomáticos: 10 días después del inicio de los síntomas, más al menos 3 días adicionales sin síntomas (incluso sin fiebre y sin síntomas respiratorios)
Para casos asintomáticos: 10 días después de la prueba positiva para SARS-CoV-2
TEST DE ANTICUERPOS PARA SARS-CoV2
Los test de anticuerpos disponibles en el mercado son de naturaleza variada, desde los tets de diagnóstico rápido (POCT) que detectan cualitativamente la presencia o no de anticuerpos ya sean totales o IgG e IgM, así como ensayos inmunométricos por ELISA, Quimioluminiscencia (CLIA), Electro quimioluminiscencia (ECLIA) que recuperan valores cuantitativos de anticuerpos empleando unidades arbitrarias (p.e. COI / UI/mL), lo que las hace no comparables y dificulta su entendimiento clínico, afortunadamente, se han implementado esquemas de evaluación externa de la calidad que permiten evaluar su desempeño y establecer de manera indirecta su trazabilidad ⁹
Un metanálisis publicado en Junio en el British Medical Journal evaluó el desempeño diagnóstico de test serológicos, concluye que “los ensayos serológicos para anticuerpos contra el SARS-CoV-2, especialmente las pruebas en el lugar de atención, no están listas para su uso generalizado por los médicos, el público en general o formuladores de políticas”¹⁰
Las sensibilidades agrupadas tenían una amplia gama, con mayor sensibilidad en los CLIA (97,8%) y la más baja en los LFIA (66,0%) y fueron mayores con el aumento del tiempo después de la aparición de los síntomas. El rango de especificidades fue más estrecho, de 96,6% a 99,7%. ¹⁰
Dada la dinámica de la respuesta inmune humoral donde la mediana de aparición anticuerpos IgM es de12 días post infección e IgG de 14 días, no debe considerarse para el diagnóstico de infección aguda, la detección de anticuerpos IgM per sé, especialmente si no se encuentra acompañados de IgG, por cuanto es altamente probable se traten de resultados falsos positivos debidos a reacciones cruzadas con otras cepas de coronavirus diferentes a SARS-CoV2 u otras condiciones. Por lo expuesto, estos test no deben ser empleados como diagnósticos y su utilidad debe centrarse en el escenario epidemiológico y de monitoreo de exposición.¹¹’ ¹² (Figura3). En el contexto del comportamiento de la respuesta inmune humoral, se ha encontrado que si bien esta al parecer se mantiene durante 3 a 4 meses, existen personas que no desarrollan respuesta inmune (seroconversión), probablemente asociado a la respuesta inmune celular T específica mediada porlinfoitos T CD4+, dato este que indicaría que la medición de anticuerpos puede llevar a una subestimación de la tasa de exposición al virus.¹³
TEST DE ANTIGENO para SARS-CoV2
Las pruebas rápidas de antígenos se utilizan comúnmente en el diagnóstico de patógenos respiratorios, incluidos los virus de la influenza y el virus sincitial respiratorio (RSV). La FDA ha otorgado una autorización de uso de emergencia (EUA) para las pruebas de antígenos que pueden identificar el SARS-CoV-2 desde julio de este año.¹⁴’ ¹⁵ (https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/vitro-diagnostics-euas#individual-antigen)
La mayoría de estos test se basan en inmunocromatografía de flujo lateral, en donde sobre una fase sólida se colocan anticuerpos contra el antígeno de SARS-CoV2 seleccionado (habitualmente contra la proteína S de la espiga “spike” del virus, que al parecer es la más altamente antigénica).¹⁶
El mejor rendimiento de los test se observa en pacientes con elevada carga viral (Ct ≤25 o copias de genoma viral >106 /mL), el cual aparece habitualmente en pacientes pre-sintomáticos (1-3 días antes de aparición de síntomas) o en las fases sintomáticas tempranas de la enfermedad (dentro de los primeros 5-7 días). Tiempos superiores a 5-7 días tras la aparición de los síntomas suponen menores cargas virales y un aumento de probabilidad de falsos negativos. Los desempeños de los test de antígenos muestran sensibilidades inferiores a las de RT-PCR y al igual que éste una alta especificidad. Las similitudes y diferencias entre el test de antígeno y el RT-PCR se muestran a continuación.¹⁶’ ¹⁷
Tomado y adaptado de: CDC. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. Update Sept 4, 2020. https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html#table2.
Los escenarios apropiados para su uso y las situaciones en las que NO se recomienda su uso, acorde a la guía de orientación provisional para la detección de antígenos en el diagnóstico de la infección por SARS-CoV2 mediante inmunoensayos rápidos se resumen a continuación.¹⁶’ ¹⁷
ESCENARIOS PARA USO APROPIADO
SITUACIONES EN LAS QUE NO SE RECOMIENDA SU USO
Situaciones frecuentes e interpretación de pruebas diagnósticas
La siguiente tabla resume algunos casos frecuentes que combinan los hallazgos de RT-PCR para SARS-CoV2 de diagnóstico y previas, así como la seroconversión. Las conclusiones que se generan para cada caso son recomendaciones del autor basadas en la información técnica al momento actual y debe ser consideradas como tal.
Bibliografía
1. Ecuador RC del. Ecuador en Cifras [Internet]. 2020 [cited 2020 Oct 1]. Available from: https://www.registrocivil.gob.ec/)
2. Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. Jama [Internet]. 2020;2019:2019–21. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32374370
3. Agencia Nacional de Regulación C y VS. Pruebas Rápidas y reactivos PCR aprobados por ARCSA [Internet]. 2020 [cited 2020 Sep 30]. Available from: https://www.controlsanitario.gob.ec/
4. Watson J, Whiting PF, Brush JE. Interpreting a covid-19 test result. BMJ [Internet]. 2020;369(May):1–7. Available from: http://dx.doi.org/doi:10.1136/bmj.m1808
5. Jarrom D, Elston L, Washington J, Prettyjohns M, Cann K, Myles S, et al. The Effectiveness of Tests to Detect the Presence of SARS-CoV-2 Virus, and Antibodies to SARS-CoV-2, to Inform COVID-19 Diagnosis: A Rapid Systematic Review. SSRN Electron J. 2020;0(0):1–13.
6. Lippi G, Simundic A-M, Plebani M. Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019 (COVID-19). Clin Chem Lab Med. 2020;0(0).
7. Li D, Wang D, Dong J, Wang N, Huang H, Xu H, et al. False-negative results of real-time reverse-transcriptase polymerase chain reaction for severe acute respiratory syndrome coronavirus 2: Role of deep-learning-based ct diagnosis and insights from two cases. Korean J Radiol. 2020;21(4):505–8.
8. World Health Organization. Criteria for releasing COVID-19 patients from isolation. WHO website [Internet]. 2020;(17 June):1–5. Available from: https://www.who.int/publications/i/item/criteria-for-releasing-covid-19-patients-from-isolation
9. Özçürümez MK, Ambrosch A, Frey O, Haselmann V, Holdenrieder S, Kiehntopf M, et al. SARS-CoV-2 antibody testing—questions to be asked. J Allergy Clin Immunol. 2020;146(1):35–43.
10. Lisboa Bastos M, Tavaziva G, Abidi SK, Campbell JR, Haraoui LP, Johnston JC, et al. Diagnostic accuracy of serological tests for covid-19: Systematic review and meta-analysis. BMJ. 2020;370.
11. Watson J, Richter A, Deeks J. Testing for SARS-CoV-2 antibodies. BMJ. 2020;370:1–6.
12. Cheng MP, Yansouni CP, Basta NE, Desjardins M, Kanjilal S, Paquette K, et al. Serodiagnostics for Severe Acute Respiratory Syndrome–Related Coronavirus-2. Ann Intern Med. 2020;1–12.
13. Floriane Gallais, Aurélie Velay, Marie-Josée Wendling, Charlotte Nazon, Marialuisa Partisani, Jean Sibilia, Sophie Candon SF-K. Intrafamilial Exposure to SARS-CoV-2 Induces Cellular Immune Response without Seroconversion. medRxiv. 2020;2(33):1–15.
14. Testing S. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2 Using Antigen Tests Coronavirus Disease 2019 ( COVID-19 ) De nitions of Diagnostic , Screening , and Surveillance Testing for SARS-CoV-2 Rapid Antigen Testing for SARS-CoV-2. 2020;2019:1–7.
15. WHO. Advice on the use of point-of-care immunodiagnostic tests for COVID-19. 2020;(April):1–6.
16. World Health Organization (WHO). Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays. Interim Guid [Internet]. 2020;(September):9. Available from: https://www.who.int/publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays
17. Pineda Tenor D, Avivar Oyonarte C. Resumen Ejecutivo OMS Ag-RDTs SARS-CoV-2 [Internet]. 2020. Available from: https://www.sanac.org/images/site/Resumen_ejecutivo_Ag-RDTs_SARS-CoV-2.pdf














Comentarios